
UDI码(医疗器械唯一标识)的申请和实施需遵循相关法规和编码标准,涵盖国内及国际(如欧盟)要求。
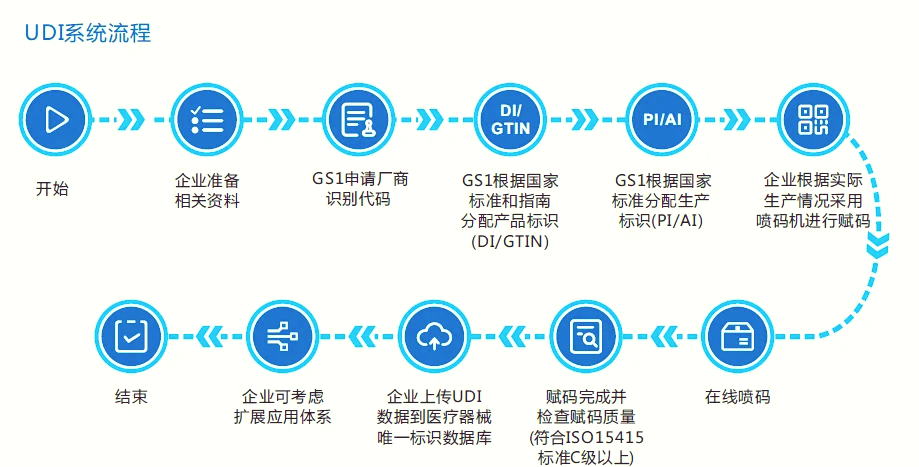
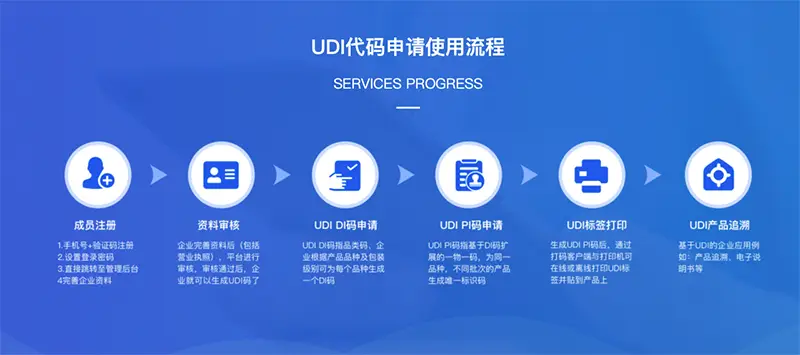
首先,企业需向中国物品编码中心申请厂商识别代码,通过在线平台提交营业执照等材料,审核通过后获得代码。

其次,编制UDI-DI(产品标识)和UDI-PI(生产标识):DI部分需根据产品特性(如名称、规格、包装形式)编制,遵循GS1标准(如应用标识符AI 01对应GTIN);PI部分可包含序列号、批号、生产日期、失效日期等信息。
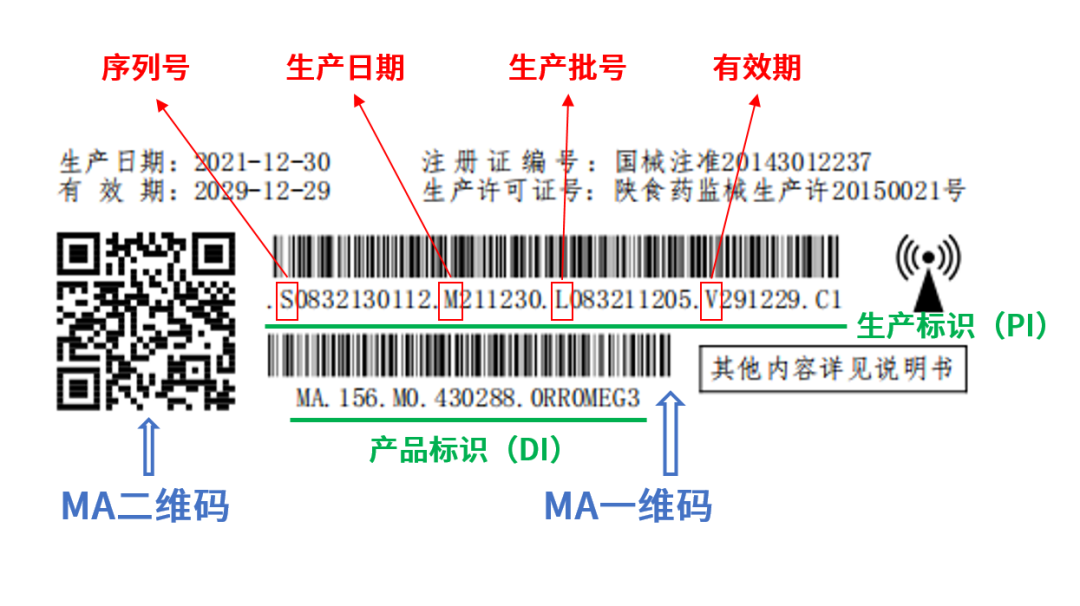
第三,赋码阶段需选择条码(如一维码、二维码)或RFID标签,并确保标签符合国家标准(如GB/T 16986),同时进行打码设备采购和合规检测。

第四,数据备案需在指定数据库提交信息:国内企业应在国家药监局UDI数据库(如UDI注册系统)录入DI数据,PI数据暂未强制要求;出口欧盟的企业则需在EUDAMED数据库注册,申报Basic UDI-DI和UDI-DI,并获取经济运营商SRN。
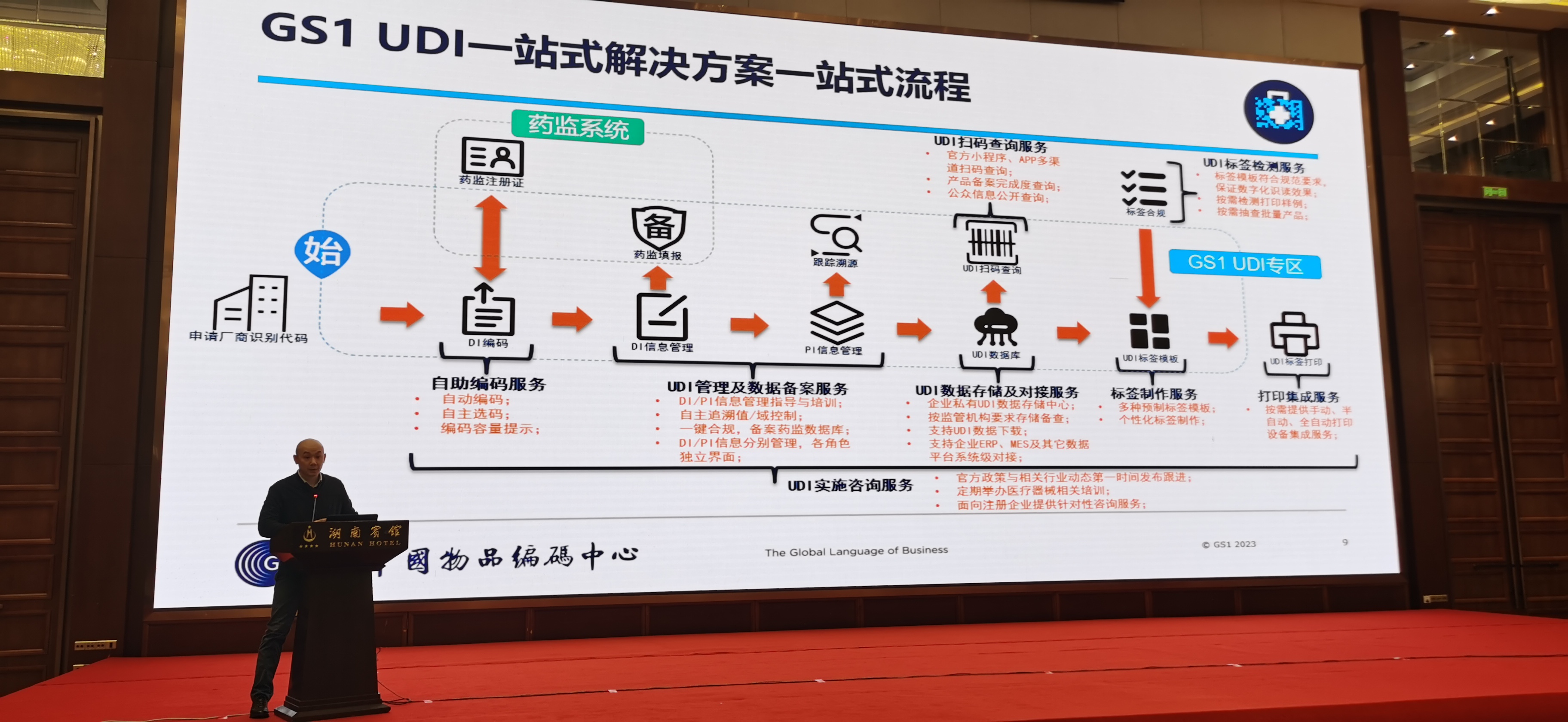
最后,实施后需定期维护数据,包括更新PI信息、应对流通追溯需求,并考虑使用GS1 UDI服务平台等工具提升效率。
企业自行编制UDI码需熟悉法规和编码规则,但若资源有限或需确保国际合规,建议通过专业平台降低风险,如慧铭佳UDI。