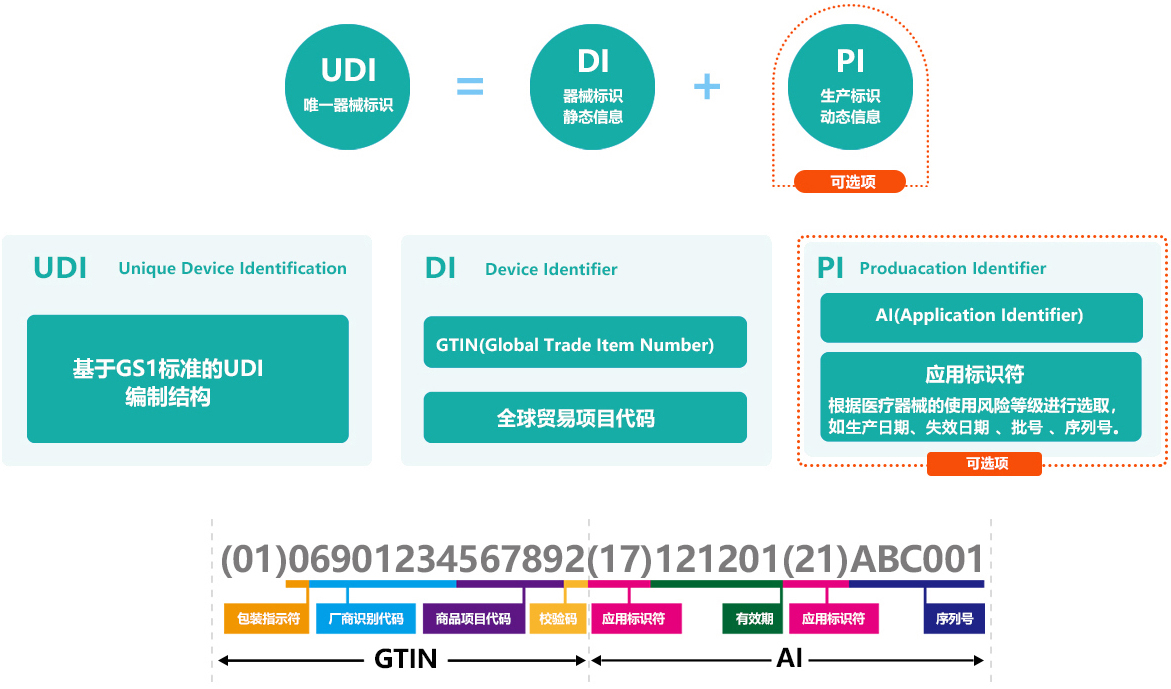
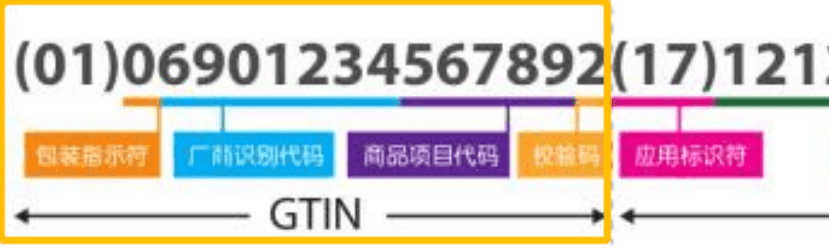
1. FDA对于I类产品,是否UDI赋码必须是DI+PI,还是只需要DI就可以?以及欧盟I类医疗器械的情况?
FDA可以不包含PI,但欧盟MDR/IVDR需要包含PI。这意味着在设计UDI数据库操作时,需要考虑到不同地区的法规要求,特别是对于I类产品,可能需要根据使用地区的法规来决定是否包含PI。
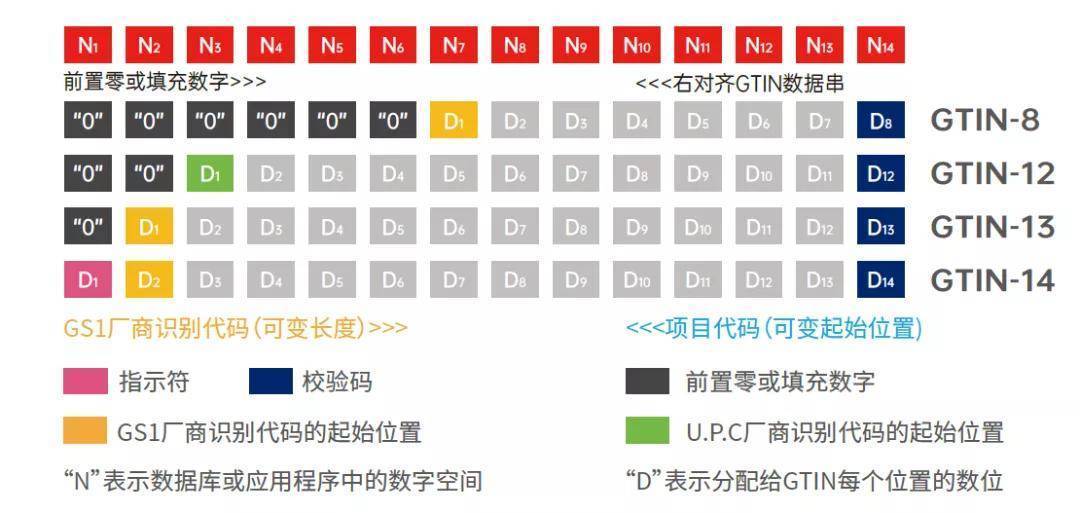
2. UDI条码大小和条码等级有要求吗?
以GS1要求为例,常见的GS1条码包括EAN/UPC、ITF-14、GS1-128和GS1DataMatrix等,条码的大小和条码等级需要满足该条码的相关标准。在设计UDI数据库操作时,需要确保条形码的大小和等级符合相关的标准规定。
3. CE认证现在是不是所有产品都需要UDI?
虽然具体要求可能因产品类别和地区而异,但可以推测,随着UDI的重要性日益增加,未来很可能有更多的医疗器械产品需要配备UDI进行CE认证。在设计UDI数据库操作时,需要考虑到这一趋势,并确保产品的UDI符合相关的认证要求。
4. 永久性标识是什么意思?
永久性标识指的是在医疗器械的使用过程中,UDI的载体应该是永久的和可读的。在设计UDI数据库操作时,需要考虑到这一点,并确保UDI能够在医疗器械的整个生命周期内保持可读性。
5. 灭菌产品和非灭菌产品可以用同一组BasicUDI-DI吗?
由于灭菌产品和非灭菌产品的风险等级不同,因此不应使用同一组BasicUDI-DI。在设计UDI数据库操作时,需要为不同种类的医疗器械分配不同的BasicUDI-DI。
6. 在国内申请GS1再做欧盟的CE认证码?还是需要在GS1国外官网单独申请?
在国内的企业只需要在中国物品编码中心(GS1China)上申请厂商识别码即可。这意味着企业在进行UDI数据库操作时,可以根据自身的实际情况选择合适的方式进行UDI的申请和管理。
 UDI网-UDI申请编码赋码软件专业知识网
UDI网-UDI申请编码赋码软件专业知识网