1. 通过国家药监局数据库注册人/备案人登录系统后,直接在网页单个DI填报提交或下载表格模版,批量填写信息后导入申报。
这种方式需要注册人/备案人在注册/备案管理系统中提交其产品标识,包括填写产品标识基本信息、产品基本信息、生产标识信息等。然后将DI编码上报药监局平台,药监局数据库会对所有DI数据进行审核并公布申报情况。

2. 通过慧铭佳UDI服务平台完成UDI实施工作,登录后在后台单个DI自动编码或填写表格批量DI自动编码,导入申报信息后,直接点击一键申报,自动完成DI申报。
这种方式更加便捷,平台提供专家一对一咨询指导,可以帮助企业快速完成UDI申报。
在选择申报方式时,企业应根据自身情况和需求来决定。
UDI申报的注意事项:
一、UDI的申请
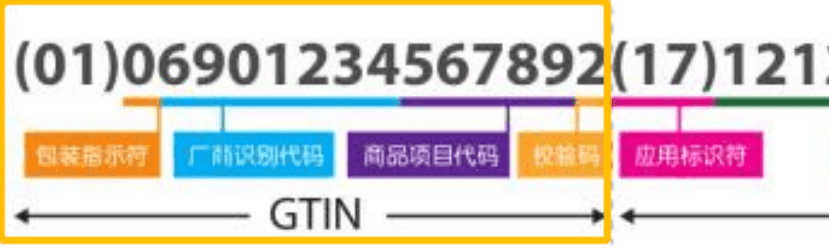
1、向中国物品编码中心申请厂商识别码。
2、审批后,购买条码及软件。
3、同时条码中心进行商品项目代码备案。
4、企业终会拿到医疗行业的UDI。
二、唯一数据库
1、医疗器械唯一标识数据库定义:
数据库包含医疗器械的产品标识及相关数据。国家食品药品监督管理总局制定医疗器械唯一标识数据相关标准及规范,组织建立医疗器械唯一标识数据库,供公众查询。
解释:NMPA负责建立一个数据库,供公众查询,就跟医疗器械产品数据库一样。
2、唯一标识数据的提交要求:
注册人或者备案人应当在申请医疗器械注册或办理备案时,在注册/备案管理系统中提供申报产品的产品标识。
注册人或者备案人应当在其产品获准注册、取得备案或者变更后30个工作日内,将产品标识及相关数据上传至医疗器械唯一标识数据库。
解释:这里明确指出:产品注册/备案时需同时提交申报产品的产品标识且获得注册证或取得备案后录入标识数据库。这就意味着产品的UDI是需要备案的,就跟型号规格一样,不能随便更改。
三、UDI相关标准及资料
1、总局办公厅公开征求医疗器械唯一标识系统规则(征求意见稿)意见
2、关于征求《医疗器械唯一标识系统术语和定义》医疗器械行业标准意见的通知
3、关于征求《医疗器械唯一标识通用要求》医疗器械行业标准意见的通知
4、基于GS1标准的五一器械标识(UDI)编制规范实现医疗器械可追溯
5、FDA UDI 实施规定以及如何申请唯一器械标识码
四、注意事项
UDI的申请流程并不复杂,大的问题是企业内部需要对DI中商品项目代码做好内部的规定。涉及到包装的还需要对不同包装做好规定。这就跟ERP系统建立时物料编码一样。不能随便编制一个,要考虑到系统性、长远性。早在2006年,上海市监管部门就开展了部分植入性医疗器械编码追溯试点工作。
 UDI网-UDI申请编码赋码软件专业知识网
UDI网-UDI申请编码赋码软件专业知识网