2023年2月17日,国家药监局、国家卫生健康委、国家医保局联合发布《关于做好第三批实施医疗器械唯一标识工作的公告》(2023年第22号),《公告》明确,为更有效地管理与监督医疗器械行业,将一系列常用的、风险较高的医疗器械列入第三批UDI实施名单。此次名单涵盖了一次性使用产品、集中带量采购中选产品以及医疗美容相关产品等。总计有15个大类、103种产品纳入此项计划,从2024年6月1日开始执行。
18 妇产科、辅助生殖和避孕器械
01 妇产科手术器械
05 妇产科用扩张器、牵开器描述:
通常是一系列不同规格的条/棒状器械。一般由高分子材料制成。无菌提供。
通常由硅橡胶导管、球囊和充盈接头组成,可有可调式针芯。一般由高分子材料制成。无菌提供。
预期用途:
用于机械扩张子宫颈、牵开阴道及会阴组织。
举例:
一次性使用无菌宫颈扩张棒
一次性无菌球囊宫颈扩张器
管理类别:II类部分
10 子宫输卵管造影、输卵管通液器械
描述:
通常由导管、连接件、保护套管组成。一般由高分子材料制成。无菌提供。
预期用途:
用于输卵管造影、疏通。
举例:
输卵管造影导管、输卵管导管
管理类别:II类部分
04 妇产科治疗器械
02 妇科假体器械
描述:
一般由金属或非金属材料制成。
一般由发泡橡胶材料制成。形体构造可与宫颈贴合。所含成分不具有药理学作用。
预期用途:
放置于妇女阴道(宫颈口),起到支持、支撑作用。在人体的滞留时间大于 24 小时小于 30 天。
通过发泡橡胶的吸附作用将宫颈表面及宫颈口内的糜烂物、粘膜吸附在产品上,取出时将糜烂物带出。用于辅助治疗宫颈炎。在人体的滞留时间大于24 小时小于 30 天。
举例:
子宫托
治疗托
管理类别:II类部分
07 辅助生殖器械
01 辅助生殖导管
描述:
通常由导引导管、外套管、移植导管、连接件、保护套管组成。一般由高分子材料制成。无菌提供。
预期用途:
授精导管用于经阴道插入子宫腔内,注入精液,进行人工授精。胚胎移植导管用于经阴道向子宫内移植经过体外授精(IVF)后的胚胎。
举例:
胚胎移植导管、人工授精导管
管理类别:II
02 辅助生殖穿刺取卵/精针
描述:
通常由针管、针套、针柄、软管以及胶塞接口、负压连接头、吸引管、真空管、冲洗管组成。无菌提供。
预期用途:
用于经由阴道对卵巢穿刺及从卵巢卵泡中对卵母细胞进行抽吸和冲洗。
用于经皮睾丸/附睾穿刺取精。
举例:
一次性使用无菌取卵针、单腔/双腔取卵针、卵母细胞采集器
睾丸穿刺取精器、附睾穿刺针、睾丸穿刺活检枪
管理类别:II
03 辅助生殖微型工具 II
描述:
辅助生殖用微型工具。包括 IVF 显微操作用注射、持卵、剥离、活检、辅助孵化和取精用的微细管状和针状工具。还包括与生殖细胞和胚胎接触的器皿、盘板。无菌提供。
预期用途:
用于体外环境下操作或储存人类生殖细胞以及胚胎,包括精子显微注射,胚胎活检以及辅助孵化。
举例:
体外受精显微操作管、显微吸液管、胚胎活检针、辅助生殖用培养器皿、玻化冻存管
管理类别:II
19医用康复器械
01 认知言语视听障碍康复设备
07 助听器
描述:
通常由传声器、放大器和耳机组成,并由电池供电。用来放大声音、补偿听力损失的电子装置。
预期用途:
用于听力损失患者的听力补偿。
举例:
耳背式助听器、耳内式助听器、盒式助听器、骨导式助听器
管理类别:II
22 临床检验器械
01 血液学分析设备
02 血细胞分析仪器
描述:
通常由血细胞检测模块、血红蛋白测定模块、机械模块、电子模块、计算机系统等组成。原理一般为电阻抗法、比色法、流式激光散射技术等。
预期用途:
用于对血液/体液中有形成分进行定量定性分析,并提供相关信息。
举例:
血细胞分析仪、全自动血细胞分析仪、全自动五分类血细胞分析仪、全自动三分群血细胞分析仪、干式血球计数仪、全自动模块式血液体液分析仪/系统、半自动血细胞分析仪、血细胞计数器、T淋巴细胞计数仪(非流式)、白细胞计数仪
管理类别:II
11 采样设备和器具
04 静脉血样采血管
描述:
通常由管和头盖组成。管材一般由 PET(聚对苯二甲酸乙二醇酯)或玻璃管制成,管内壁附着或不附着添加剂或附加物。
预期用途:
与一次性使用采血针配合使用,用于人体静脉血的收集、运输、存储。
举例:
一次性使用真空采血管、一次性使用真空静脉采血管、一次性使用真空静脉血样采集容器、一次性使用静脉血样采集容器、一次性使用非真空采血管
管理类别:II
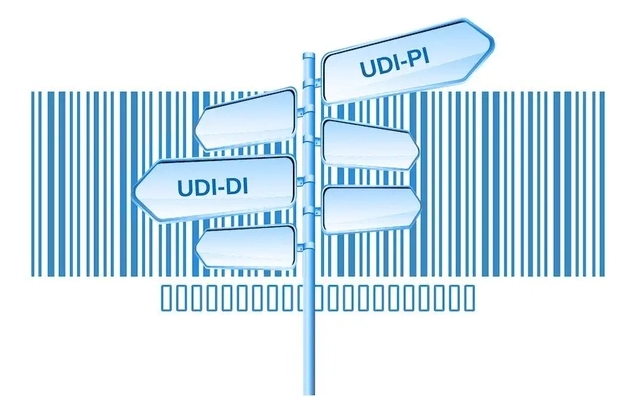
UDI编码的构成
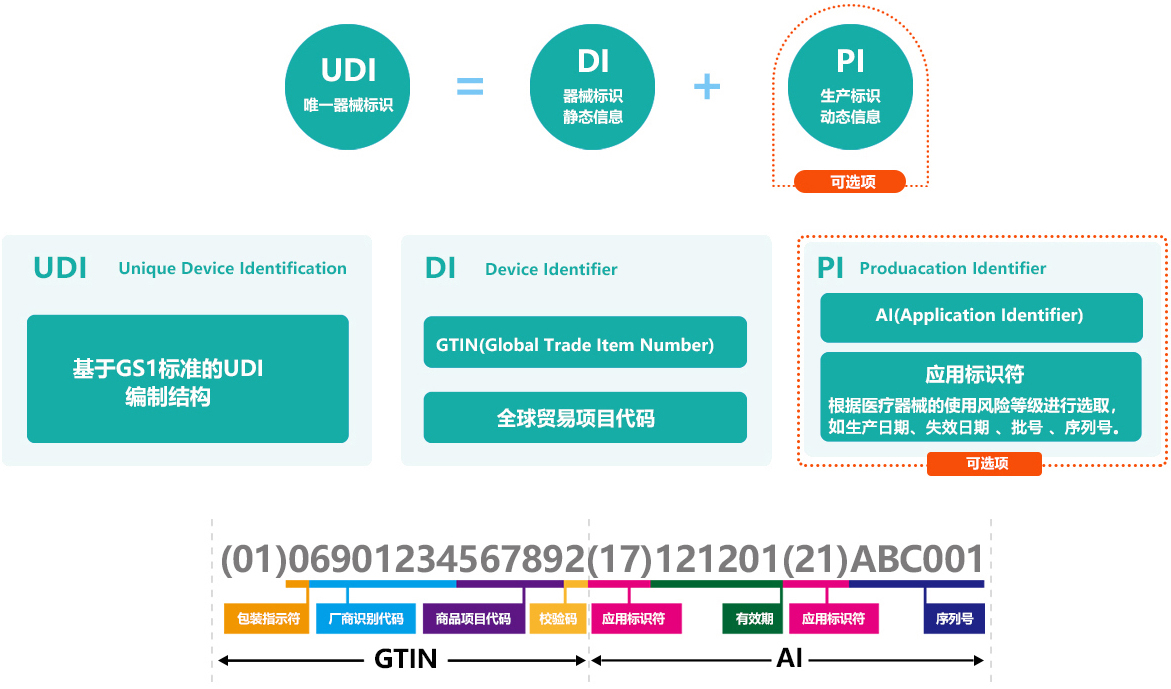
医疗器械唯一标识(UDI)是一种用于医疗器械全生命周期追溯的唯一标识码,其编码结构主要包括两个部分:产品标识(DI)和生产标识(PI)。
产品标识(DI)
产品标识是UDI的固定部分,由企业识别码和产品规格码两部分组成。企业识别码是由注册人或备案人申请,并由发码机构依申请受理分配的全球唯一的企业识别码。产品规格码则是由注册人或备案人根据其生产的产品型号、规格及包装等特征编制的代码。由企业识别码和产品规格码组成的DI是全球唯一的。
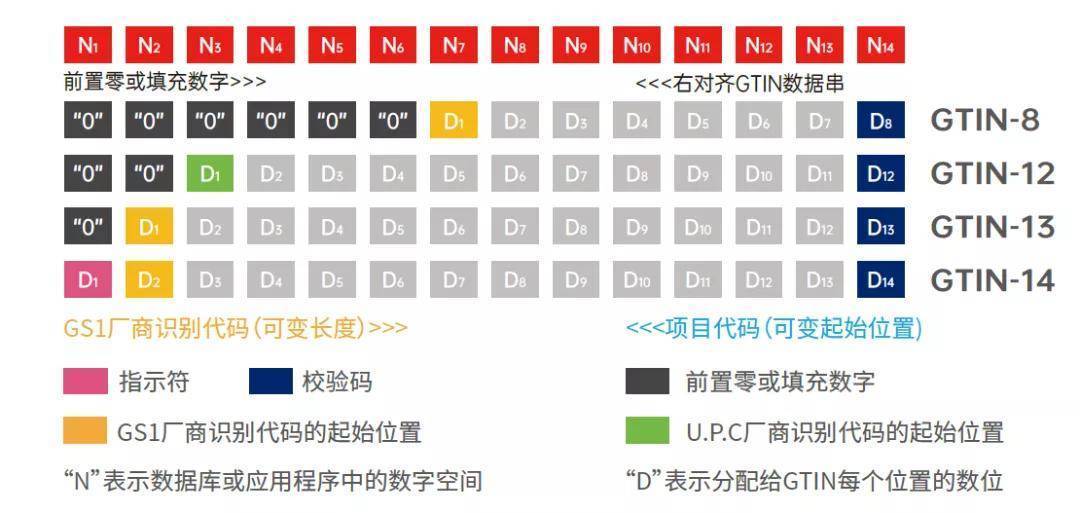
在GS1编码体系中,产品标识为识别注册人/备案人、医疗器械型号规格和包装的唯一代码。它包含包装编码、厂商识别代码、商品项目代码和校验位。厂商识别代码由7-10位数字组成,由中国物品编码中心负责分配和管理。厂商识别代码的前3位代码为前缀码,国际物品编码组织分配给中国物品编码中心的前缀码为690-699。商品项目代码由2-5位数字组成,由注册人/备案人、生产企业根据相应编码规则编制。校验码为1位数字,用于检验整个编码的正确性。
生产标识(PI)
生产标识是UDI的非必须、可变部分,可以根据实际应用需求包含医疗器械序列号、生产批号、生产日期、失效日期等信息。这些信息是动态的,可以根据企业需要选择合适的应用标识符代表生产内容。例如,生产日期可以使用应用标识符(AI)“11”编制,失效日期可以使用AI“17”编制,批号可以使用AI“10”编制,序列号可以使用AI“21”编制。
UDI编码的整体结构
UDI编码整体上是由指示位、厂商识别代码、商品项目代码、校验位以及动态的信息如生产日期、失效日期、批号或序列号等组成。这些信息共同构成了一个唯一且能够追溯医疗器械全生命周期的标识码。
注意事项
企业在使用UDI编码时,需要注意括号中的数字不仅是编码时存在,赋码时也不能省略,需要打印在标签码图下方。若手动输入错误可能造成UDI无法识别。此外,不同的应用标识符对应着不同的含义,企业在选择使用时需要根据自身的需求进行选择。
综上所述,UDI编码的构成复杂且细致,涉及到多个方面的信息,包括企业的身份信息、产品的规格信息以及生产过程中的相关信息等。这样的设计旨在实现对医疗器械全生命周期的追溯和管理。
 UDI网-UDI申请编码赋码软件专业知识网
UDI网-UDI申请编码赋码软件专业知识网